Вемурафениб
| Вемурафениб | |
|---|---|
 | |
 | |
| Химическое соединение | |
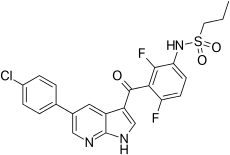
| ИЮПАК | N-(3-{[5-(4-Chlorophenyl)-1H-pyrrolo[2,3-b]pyridin-3-yl]carbonyl}-2,4-difluorophenyl)propane-1-sulfonamide |
| Брутто-формула | C23H18ClF2N3O3S |
| Молярная масса | 489.92 g/mol |
| CAS | 918504-65-1 |
| PubChem | 42611257 |
| DrugBank | DB08881 |
| Классификация | |
| АТХ | L01XE15 |
| Способ введения | |
| Орально (таблетки) | |
Вемурафениб — ингибитор BRAF-киназ с активирующими мутациями в кодоне V600E, разработанный компанией Plexxikon (теперь часть Daiichi-Sankyo) и компанией Genentech для лечения поздних стадий меланомы. Наименование вемурафениб происходит от V600E mutated BRAF inhibition. Распространяется под торговой маркой Зелбораф (Zelboraf).
Содержание
Допуск к применению
17 августа 2011 года вемурафениб был допущен FDA к применению для лечения поздних стадий меланомы, став первым препаратом, созданным на основе фрагментного подхода, получившим одобрение регулятора.
15 февраля 2012 года вемурафениб был допущен к применению Министерством здравоохранения Канады.
20 февраля 2012 года Европейская комиссия допустила к применению вемурафениб в качестве монотерапии для лечения взрослых пациентов с мутацией BRAF V600E, страдающих неоперабельной или метастатической меланомой, наиболее агрессивной формой рака кожи.
Механизм действия
Вемурафениб вызывает запрограммированную смерть клетки в клеточной линии меланомы.
Вемурафениб работает только в меланоме пациентов, у которых заболевание было вызвано мутацией V600E BRAF, то есть если на аминокислотной последовательности ДНК, кодирующей белок B-Raf, в позиции № 600 нормальный валин заменён на глутаминовую кислоту. Около 60 % меланом вызваны этой мутацией. Препарат так же эффективен против редкой мутации V600K в том же гене. Клетки меланомы без этих мутаций не ингибируются вемурафенибом; препарат парадоксально стимулирует нормальный B-Raf белок и может способствовать росту опухоли в таком случае.
Устойчивость
Были обнаружены три механизма устойчивости к вемурафенибу (покрытие 40 % случаев):
- В раковых клетках происходит гиперэкспрессия гена клеточного поверхностного белка PDGFRB, создавая альтернативный путь для выживания.
- Второй онкоген под названием NRAS видоизменяется, повторно активируя нормальный путь выживания BRAF.
- Секреция стромальными клетками фактора роста гепатоцита (HGF).
Клинические испытания
В фазе I клинических исследований вемурафенибу (тогда он был известен как PLX4032) удалось снизить количество раковых клеток в более чем половине группы из 16 пациентов с меланомой. В опытной группе среднее время выживания увеличилось на 6 месяцев по сравнению с контрольной группой.
На втором этапе исследования, которое проходило на пациентах с мутацией V600E в B-Raf, примерно в 80 % случаев удалось добиться частичной или полной регрессии. Регрессия длилась от 2 до 18 месяцев.
В начале 2010 года начался I этап испытаний для солидных опухолей (включая колоректальный рак), II фаза испытаний (для метастазирующей меланомы) продолжаются.
Фаза III клинических испытаний (по сравнению с дакарбазином) у пациентов с ранее не получавших лечения метастатической меланомы показала улучшение показателей общей и безрецидивной выживаемости.
В июне 2011 года положительные результаты были зафиксированы в III фазе исследования при лечении меланомы, вызванной мутацией BRIM3 BRAF. В 2012 году были получены обновлённые хорошие результаты по лечению этой формы меланомы.
В следующих исследованиях проведено испытание комбинаций вемурафениба с GDC-0973 (Кобиметиниб), с МЕК-ингибиторами. После хороших результатов, полученных в 2014 году, эти комбинации были представлены для одобрения в EC и FDA.
В январе 2015 года получены результаты испытания эффективности вемурафениба по сравнению с комбинацией дабрафениба с траметинибом для метастатической меланомы.
Побочные эффекты
При максимальной переносимой дозе (МПД) по 960 мг дважды в день 31 % больных получили поражение кожи, которое могло потребовать хирургического удаления. Во второй фазе исследований участвовали 132 пациента; наиболее частыми побочными эффектами были боль в суставах (у 58 % больных), сыпь на коже (у 52 %), фоточувствительность (у 52 %). Для того, чтобы уменьшить проявление побочных эффектов, у 45 % пациентов была изменена дозировка. Медиана суточной дозы составила 1750 мг, (91 % от МПД).
В апреле 2013 года испытания эффективности комбинации ипилимумаба с вемурафенибом были остановлены из-за признаков печёночной токсичности.